
产品货号:
WH0012
中文名称:
血液基因组DNA提取试剂盒(0.1-1ml)
英文名称:
Extraction kit for genomic DNA from blood(0.1-1ml)
产品规格:
50次|200次
发货周期:
1~3天
产品价格:
询价
本试剂盒采用可以特异性结合DNA的离心吸附柱和独特的缓冲液系统,提取血液中的基因组DNA。离心吸附柱中采用的硅基质材料为本公司特有新型材料,高效、专一吸附DNA,可最大限度去除杂质蛋白及细胞中其他有机化合物。提取的基因组DNA片段大,纯度高,质量稳定可靠。
产品特点:
·样本适用广泛:可从抗凝血(EDTA,肝素等)、白膜层和血凝块等样品中直接提取基因组DNA;
·高质量:独特的裂解缓冲体系,纯化的DNA具有高浓度,高纯度,完整性好等特点,满足芯片杂交,高通量测序等实验需求;
·快速无毒:采用硅胶膜吸附原理,无需酚/氯仿,1h内即可完成实验。
·应用范围广:适用于酶切、PCR、文库构建、Southern杂交等各种常规实验,和芯片杂交、高通量测序等下有实验。
提取实例:
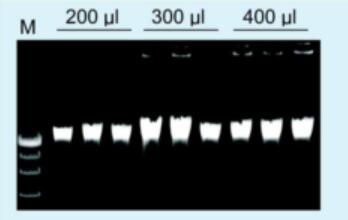
用本试剂盒提取不同体积血液基因组,1%琼脂糖凝胶,6V/cm,电泳20min,Marker为λDNA/Hind III。
提取得率:
试剂盒组成:
保存条件:室温(15-25℃)干燥条件下,可保存12个月,更长时间的保存可置于2-8℃。2-8℃保存条件下,若溶液产生沉淀,使用前应将试剂盒内的溶液在室温放置一段时间,必要时可在37℃水浴中预热10min,以溶解沉淀。
自备试剂:RNase A(100mg/ml) (目录号:WH0217),异丙醇,乙醇
注意事项:(请务必在使用本试剂盒之前阅读此注意事项)
1.样品应避免反复冻融,否则会导致提取的DNA片段较小、提取量下降。
2.若缓冲液GB中有沉淀,可在37℃水浴中重新溶解,摇匀后使用。
3.所有离心步骤均为使用台式离心机,室温下离心。
使用方法:
使用前先在缓冲液GD和漂洗液PW中加入无水乙醇,加入体积请参照瓶上的标签。
1.处理血液材料(本产品适用于处理已添加抗凝剂的100μl-1ml血液样品):
a.当血液样品体积小于200 μl时,可加缓冲液GS补足体积至200 μl,再进行下一步实验(如血液样品体积为200 μl,可直接进行下一步实验,不需加入GS)。
b.当血液样品体积超过200 μl时,需用细胞裂解液CL处理,具体步骤如下:
在样品中加入1-2.5倍体积的细胞裂解液CL,颠倒混匀,10000rpm(~11500×g )离心1 min,吸去上清,留下细胞核沉淀(如果裂解不彻底,可重复以上步骤一次),向离心收集到的细胞核沉淀中加200 μl缓冲液GS,振荡至彻底混匀。
c.如果处理血样为禽类、鸟类、两栖类或更低级生物的抗凝血液,其红细胞为有核细胞,因此处理量5-20 μl,可加缓冲液GS补足200 μl后进行下面的裂解步骤。
注意:如果需要去除RNA,可加入4 μl RNase A(100mg/ml)溶液(目录号:WH0217),振荡15 sec,室温放置5 min。
2.加入20 μl Proteinase K溶液,混匀。
3.加200 μl缓冲液GB,充分颠倒混匀,56℃放置10min,其间颠倒混匀数次,溶液应变清亮(如溶液未彻底变清亮,请延长裂解时间至溶液清亮为止)。
注意:加入缓冲液GB时可能会产生白色沉淀,一般37℃放置时会消失,不会影响后续实验。如溶液未变清亮,说明细胞裂解不彻底,可能导致提取DNA量少和提取出的DNA不纯。当血液体积≤200 μl且没有采用红细胞裂解处理,或是样本储存条件不佳,水浴后颜色可能为深褐色,注意溶液中没有团块等沉淀。
4.加200 μl无水乙醇,充分颠倒混匀,此时可能会出现絮状沉淀。
5.将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱CB3放入收集管中),12000rpm(~13400×g )离心30 sec,倒掉收集管中的废液,将吸附柱CB3放入收集管中。
6.向吸附柱CB3中加入500 μl缓冲液GD(使用前请先检查是否已加入无水乙醇),12000rpm(~13400×g )离心30 sec,倒掉收集管中的废液,将吸附柱CB3放入收集管中。
7.向吸附柱CB3中加入600 μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12000rpm(~13400×g )离心30 sec,倒掉收集管中的废液,将吸附柱CB3放入收集管中。
8.重复操作步骤7。
9.12000rpm(~13400×g)离心2 min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
注意:这一步的目的是将吸附柱中残余的漂洗液去除,漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。
10.将吸附柱CB3转入1.5 ml离心管中,向吸附膜中间位置悬空滴加50-200 μl洗脱缓冲液TB,室温放置2-5 min,12000rpm(~13400×g )离心2 min,将溶液收集到离心管中。
注意:洗脱缓冲液体积不应少于50 μl,体积过小影响回收效率。为增加基因组DNA的得率,可将离心得到的溶液再加入吸附柱CB3中,室温放置2 min,12000rpm(~13400×g )离心2 min。洗脱液的pH对于洗脱效率有很大影响。若用ddH2O做洗脱液应保证其pH值在7.0-8.5范围内,pH值低于7.0会降低洗脱效率;且DNA产物应保存在-20℃,以防DNA降解。
DNA浓度及纯度检测:
1.得到的基因组DNA片段的大小与样品保存时间、操作过程中的剪切力等因素有关。回收得到的DNA片段可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。
2.DNA应在OD260处有显著吸收峰,OD260值为1相当于大约50 μg/ml双链DNA、40 μg/ml单链DNA。
3.OD260/OD280比值应为1.7-1.9,如果洗脱时不使用洗脱缓冲液,而使用ddH2O,比值会偏低,因为pH值和离子存在会影响光吸收值,但并不表示纯度低。
相关搜索:血液基因组DNA提取试剂盒(0.1-1ml),少量血液基因组DNA柱式提取试剂盒,少量血液gDNA柱式提取试剂盒,少量血液基因组DNA提取试剂盒(离心吸附柱)
产品特点:
·样本适用广泛:可从抗凝血(EDTA,肝素等)、白膜层和血凝块等样品中直接提取基因组DNA;
·高质量:独特的裂解缓冲体系,纯化的DNA具有高浓度,高纯度,完整性好等特点,满足芯片杂交,高通量测序等实验需求;
·快速无毒:采用硅胶膜吸附原理,无需酚/氯仿,1h内即可完成实验。
·应用范围广:适用于酶切、PCR、文库构建、Southern杂交等各种常规实验,和芯片杂交、高通量测序等下有实验。
提取实例:

用本试剂盒提取不同体积血液基因组,1%琼脂糖凝胶,6V/cm,电泳20min,Marker为λDNA/Hind III。
提取得率:
| 材料 | 提取量 | DNA得量 |
| 哺乳动物全血 | 100μl-1ml | 3-30μg |
| 禽类、两栖类全血 | 5-20 μl | 5-40 μg |
试剂盒组成:
| 组分 | 50T | 200T |
| 细胞裂解液CL | 60 ml | 250 ml |
| 缓冲液GS | 15 ml | 50 ml |
| 缓冲液GB | 15 ml | 50 ml |
| 缓冲液GD | 13 ml | 52 ml |
| 漂洗液PW | 15 ml | 50 ml |
| 洗脱缓冲液TB | 15 ml | 60ml |
| Proteinase K | 1ml | 4×1ml |
| 吸附柱CB3 | 50个 | 200个 |
| 收集管(2 ml) | 50个 | 200个 |
| 1.5 ml离心管 | 50个 | 200个 |
保存条件:室温(15-25℃)干燥条件下,可保存12个月,更长时间的保存可置于2-8℃。2-8℃保存条件下,若溶液产生沉淀,使用前应将试剂盒内的溶液在室温放置一段时间,必要时可在37℃水浴中预热10min,以溶解沉淀。
自备试剂:RNase A(100mg/ml) (目录号:WH0217),异丙醇,乙醇
注意事项:(请务必在使用本试剂盒之前阅读此注意事项)
1.样品应避免反复冻融,否则会导致提取的DNA片段较小、提取量下降。
2.若缓冲液GB中有沉淀,可在37℃水浴中重新溶解,摇匀后使用。
3.所有离心步骤均为使用台式离心机,室温下离心。
使用方法:
使用前先在缓冲液GD和漂洗液PW中加入无水乙醇,加入体积请参照瓶上的标签。
1.处理血液材料(本产品适用于处理已添加抗凝剂的100μl-1ml血液样品):
a.当血液样品体积小于200 μl时,可加缓冲液GS补足体积至200 μl,再进行下一步实验(如血液样品体积为200 μl,可直接进行下一步实验,不需加入GS)。
b.当血液样品体积超过200 μl时,需用细胞裂解液CL处理,具体步骤如下:
在样品中加入1-2.5倍体积的细胞裂解液CL,颠倒混匀,10000rpm(~11500×g )离心1 min,吸去上清,留下细胞核沉淀(如果裂解不彻底,可重复以上步骤一次),向离心收集到的细胞核沉淀中加200 μl缓冲液GS,振荡至彻底混匀。
c.如果处理血样为禽类、鸟类、两栖类或更低级生物的抗凝血液,其红细胞为有核细胞,因此处理量5-20 μl,可加缓冲液GS补足200 μl后进行下面的裂解步骤。
注意:如果需要去除RNA,可加入4 μl RNase A(100mg/ml)溶液(目录号:WH0217),振荡15 sec,室温放置5 min。
2.加入20 μl Proteinase K溶液,混匀。
3.加200 μl缓冲液GB,充分颠倒混匀,56℃放置10min,其间颠倒混匀数次,溶液应变清亮(如溶液未彻底变清亮,请延长裂解时间至溶液清亮为止)。
注意:加入缓冲液GB时可能会产生白色沉淀,一般37℃放置时会消失,不会影响后续实验。如溶液未变清亮,说明细胞裂解不彻底,可能导致提取DNA量少和提取出的DNA不纯。当血液体积≤200 μl且没有采用红细胞裂解处理,或是样本储存条件不佳,水浴后颜色可能为深褐色,注意溶液中没有团块等沉淀。
4.加200 μl无水乙醇,充分颠倒混匀,此时可能会出现絮状沉淀。
5.将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱CB3放入收集管中),12000rpm(~13400×g )离心30 sec,倒掉收集管中的废液,将吸附柱CB3放入收集管中。
6.向吸附柱CB3中加入500 μl缓冲液GD(使用前请先检查是否已加入无水乙醇),12000rpm(~13400×g )离心30 sec,倒掉收集管中的废液,将吸附柱CB3放入收集管中。
7.向吸附柱CB3中加入600 μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12000rpm(~13400×g )离心30 sec,倒掉收集管中的废液,将吸附柱CB3放入收集管中。
8.重复操作步骤7。
9.12000rpm(~13400×g)离心2 min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
注意:这一步的目的是将吸附柱中残余的漂洗液去除,漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。
10.将吸附柱CB3转入1.5 ml离心管中,向吸附膜中间位置悬空滴加50-200 μl洗脱缓冲液TB,室温放置2-5 min,12000rpm(~13400×g )离心2 min,将溶液收集到离心管中。
注意:洗脱缓冲液体积不应少于50 μl,体积过小影响回收效率。为增加基因组DNA的得率,可将离心得到的溶液再加入吸附柱CB3中,室温放置2 min,12000rpm(~13400×g )离心2 min。洗脱液的pH对于洗脱效率有很大影响。若用ddH2O做洗脱液应保证其pH值在7.0-8.5范围内,pH值低于7.0会降低洗脱效率;且DNA产物应保存在-20℃,以防DNA降解。
DNA浓度及纯度检测:
1.得到的基因组DNA片段的大小与样品保存时间、操作过程中的剪切力等因素有关。回收得到的DNA片段可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。
2.DNA应在OD260处有显著吸收峰,OD260值为1相当于大约50 μg/ml双链DNA、40 μg/ml单链DNA。
3.OD260/OD280比值应为1.7-1.9,如果洗脱时不使用洗脱缓冲液,而使用ddH2O,比值会偏低,因为pH值和离子存在会影响光吸收值,但并不表示纯度低。
相关搜索:血液基因组DNA提取试剂盒(0.1-1ml),少量血液基因组DNA柱式提取试剂盒,少量血液gDNA柱式提取试剂盒,少量血液基因组DNA提取试剂盒(离心吸附柱)



